COVIDまたはワクチン後にスパイクタンパク質が体内に沈着する場所(フルチャート)
スパイクタンパク質のメカニズムに関する研究と、タンパク質が体のさまざまな側面とどのように相互作用するかについての仮説がありますが、スパイクタンパク質の存在をテストすることは困難です。
この記事は、感染とワクチン曝露の両方によるスパイクタンパク質の蓄積、それが接触できる場所、およびそれがもたらす可能性のある病状に関する現在の限られた研究をレビューすることを目的としています。
免疫細胞
スパイクタンパク質は、感染した人から採取した免疫細胞で検出されることがよくあります。多くの免疫細胞が定期的に周囲の環境をサンプリングするため、感染中またはワクチン接種後に免疫細胞に存在するスパイクタンパク質を見つけることは珍しくありません。
しかし、血液検査を使用して長期COVIDを診断する会社であるIncellDxのCEO兼創設者であるブルース・パターソン博士が率いる研究では、15か月以上にわたって長期COVIDに苦しんでいる患者の73%が依然としてスパイクタンパク質を免疫細胞に存在させていました。一方、重症および急性のCOVID患者の91%は、免疫細胞にスパイクタンパク質を持っていました。
剖検によって得られた臓器組織を評価する別の研究では、COVID-19で死亡した個人の免疫細胞に存在するスパイクタンパク質が見つかりました。これらの免疫細胞のいくつかは死に、細胞物質を除去またはリサイクルしようとしている兆候がありました。これらはすべて、スパイクタンパク質による一般的な毒性を示唆しています。
肺
肺はCOVID-19感染後の主要な損傷部位であり、非常に影響を受けやすい臓器であると考えられています。
COVID-19ワクチン接種の数日または数か月後に死亡した人々の剖検サンプルに関する研究では、これらの個人の肺細胞に強いスパイクタンパク質が存在することがわかりました。ドイツの病理学者アルネ・ブルクハルト博士が率いるチームは、ワクチン接種の9か月後に生きている人の肺細胞にスパイクタンパク質を発見し、免疫細胞が近くにあり、免疫作用の可能性を示唆しています。
感染した人々からの剖検サンプルに関する研究は、肺の重度の炎症、細胞内のスパイクタンパク質の存在、大きな免疫の存在、しばしばガス交換、瘢痕化、および肺組織の肥厚のためのより小さな領域を伴うことが見出された。
口腔および鼻腔
研究によると、SARS-CoV-2ウイルスは鼻腔や口腔から感染する可能性が高いことが示されています。
COVID検査で陽性の場合、鼻腔や口腔を拭き取り、ウイルスRNAやウイルス粒子を探すことがよくあります。SARS-CoV-2ウイルスは、鼻細胞のサンプルでその領域を拭くことによって検出されました。
COVID-19感染後に死亡した18人の患者を対象とした剖検研究では、唾液腺にスパイクタンパク質が見つかりました。その結果、腺の細胞と唾液の両方にウイルス由来のスパイクタンパク質が見つかった。彼らはまた、炎症と免疫細胞の存在を伴うスパイクタンパク質の存在、唾液腺の腫れと瘢痕化を発見し、すべてスパイクタンパク質誘発損傷の可能性を示しています。
結合組織
結合組織は、血液、骨、脂肪で構成されています。スパイクタンパク質は、3つの領域すべてで発見されています。2021年の研究では、ワクチン接種後のスパイクタンパク質がワクチン接種後最大30日間血中に残る可能性があることがわかりました。したがって、これらのスパイクタンパク質は、血管の内側を覆う内皮細胞にリスクをもたらし、スパイクタンパク質が血液凝固タンパク質に結合する能力のために血栓のリスクとしても存在します。
COVID-19で死亡した人々の染色では、骨髄中のSARS-CoV-2ウイルスタンパク質の存在も検出されました。
COVID-19感染後に死亡した47人の胸部から採取した剖検サンプルの研究では、脂肪細胞内に分布するスパイクタンパク質が見つかりました。脂肪細胞は体の代謝も調節しており、脂肪細胞の機能不全は炎症や糖尿病などの代謝性疾患につながる可能性があります。
内皮細胞
内皮細胞は体内、特に血管の内層に豊富にあります。また、内皮細胞にはスパイクタンパク質が結合できる多くの受容体があり、血管の内側を覆う細胞に対する免疫攻撃を引き起こすため、SARS-CoV-2ウイルス感染やスパイクタンパク質相互作用に対して非常に脆弱です。
ヒト血管内皮細胞の研究は、スパイクタンパク質への曝露が炎症細胞を内皮細胞に付着させ、免疫攻撃を示し、細胞の損傷や炎症による死につながる可能性があることを示しました。
ワクチン接種を受けた個人に関するBurkhardtのチームは、脳、心臓、肺、および脾臓の血管の内層を覆う内皮細胞に強いスパイクタンパク質の存在を発見しました。
これはまた、周囲の環境での免疫攻撃を伴うでしょう。チームは、特に炎症性免疫細胞に囲まれた小さな毛細血管で損傷した血管を発見し、スパイクタンパク質誘発性の損傷を示唆しています。すべての内臓に血管が供給されるため、これによりすべての内臓が危険にさらされます。
脳
SARS-CoV-2ウイルスは血液脳関門を通って脳に入ることはできませんが、マウスでの研究では、スパイクタンパク質自体がそれを通過できることが示されました。
ヒトの神経細胞培養に関する研究では、スパイクタンパク質が細胞に入り、ニューロンのタンパク質クリアランスの機能不全を引き起こし、ニューロンが消耗する可能性があることもわかりました。
ワクチン接種を受けた個人に関するブルクハルトの剖検研究では、多くの脳血管の生検でスパイクタンパク質が見つかったことがわかりました。スパイクタンパク質もニューロンで検出されましたが、速度は低かったです。
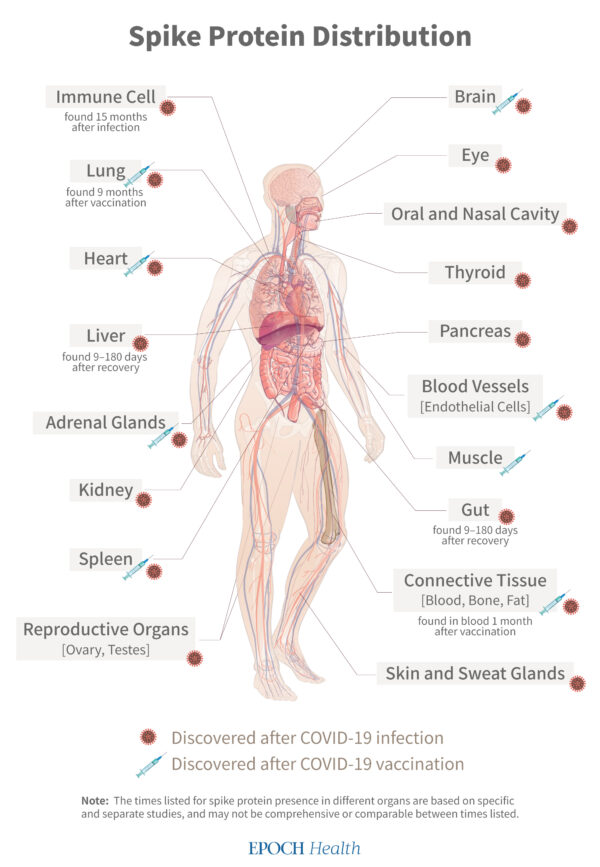
心心臓はスパイクタンパク質誘発傷害を起こしやすいです。心筋の炎症である心筋炎は、COVID-19ワクチン接種後の主要な有害事象です。
Burkhardtのチームは、死亡したワクチン接種を受けた個人の心筋にスパイクタンパク質を発見し、炎症と免疫細胞活性の兆候があり、心筋炎を示している可能性があります。
しかし、スパイクタンパク質は冠状動脈や、体内で最大の血管である大動脈にも見られました。これらの所見はすべて、免疫細胞の存在と炎症と組織損傷の重篤な兆候を伴い、心臓損傷の可能性を示唆しています。
別の実験室での研究では、スパイクタンパク質自体が心臓に損傷を与える可能性があることが示されました。ヒト組織細胞はSARS-CoV-2ウイルスに感染し、この研究では、ウイルスからのスパイクタンパク質が心臓周皮細胞に結合できることがわかりました。これらは血管細胞をサポートし、血管の収縮と拡張を制御する細胞です。スパイクタンパク質が周皮細胞に付着すると、周皮細胞はより運動性になり、血管細胞の支持が低下しました。彼らはまた、血管細胞を死滅させる引き金となる炎症誘発性の分子や化学物質を分泌しました。これらの知見はすべて、スパイクタンパク質の存在だけで心臓の損傷が起こり得ることを示唆している。
甲状腺
COVID-19感染後に亡くなった男性の剖検研究では、甲状腺生検にスパイクタンパク質が存在することがわかりました。甲状腺はホルモンの分泌に関与しています。SARS-CoV-2ヌクレオカプシドタンパク質も検出されましたが、その分布はよりまばらでした。研究によると、スパイクタンパク質の存在は炎症と細胞の損傷も伴い、甲状腺炎に似ています。甲状腺の炎症は甲状腺機能に影響を及ぼし、臓器の機能不全を引き起こす可能性があります。
甲状腺炎は、COVID-19ワクチン接種の3〜4日後に人々にも報告されており、一部の研究者は甲状腺炎がワクチン誘発であると宣言しています。
膵臓
中国の研究では、COVID-19で死亡した人々の剖検膵臓サンプルにスパイクタンパク質が見つかりました。
スパイクタンパク質は、食物を分解する酵素を生成および分泌する膵臓細胞と、血糖値を下げるためにインスリンを生成および放出する膵臓細胞の2つで見つかりました。2番目のタイプには、糖尿病などの代謝性疾患に関与することが多い膵臓ベータ細胞が含まれます。ベータ細胞の喪失は1型糖尿病につながりますが、インスリンに反応しないことは2型糖尿病の特徴です。
スパイクタンパク質が存在する感染者では、膵臓組織に細胞損傷の兆候がありました。膵臓細胞を含む膜が損傷し、細胞内の内容物が腫れて崩壊しました。これらの細胞はまた、放出のためにパッケージ化された酵素とインスリンが少なく、消化と血糖調節の低下の可能性を示唆しています。
その結果、特に膵臓のベータ細胞には、糖尿病やその他の代謝性疾患に通常見られるマーカーが存在し、SARS-CoV-2ウイルスまたはそのスパイクタンパク質が代謝機能障害の一因となる可能性があることが明らかになった。
代謝性疾患は、COVID-19感染とワクチン接種に関連しています。膵臓ベータ細胞のマーカーの変化は、基礎となる代謝性疾患がなくても、多くのCOVID患者が異常な糖レベルを持っている理由かもしれません。
肝臓
スパイクタンパク質は、回復した5人のCOVID患者で肝臓で検出されました。患者は9〜180日間SARS-CoV-2の陰性結果を報告していたため、回復を示唆しています。胆嚢にはスパイクタンパク質も存在していました。
COVID感染後に死亡した11人を対象とした別の剖検研究では、SARS-CoV-2の検査で陽性となった2人が見つかりました。しかし、すべてに脂肪肝の兆候があり、一部は瘢痕化と炎症を示し、スパイクタンパク質による肝障害の可能性を示唆していました。
腎臓
腎臓は排泄のために血液から尿をろ過する役割を果たしているため、過剰なフィルターと循環活動があります。
21人のCOVID患者を対象とした剖検研究では、腎臓のSARS-CoV-2タンパク質が陽性の1人の死亡が検出されました。他の患者はウイルスの検査で陽性ではありませんでしたが、全員が循環機能障害、ろ過の原因となる血管の鬱血、腎臓コンパートメントの損傷と拡大の兆候を伴う同様の病状を共有していました。
別の研究では、入院中のCOVID患者の尿サンプルの約25%で尿中のスパイクタンパク質が検出されました。タンパク質は尿素やナトリウムイオンなどの他の一般的に排泄される化学物質よりも大きいため、尿中のタンパク質は一般的に少量であり、高レベル(タンパク尿)は腎機能障害の兆候と見なされます。タンパク尿とネフローゼ症候群は、どちらも尿中の過剰なタンパク質排泄と特定され、機能不全の腎臓機能に関連しており、COVID感染中およびワクチン接種後に文書化されています。
腸
ウイルス検査で陰性になってから9日から180日後のCOVID患者5人を対象とした研究では、回腸(小腸の端)、虫垂、結腸、肛門と下部直腸の腫れた静脈である痔核にスパイクタンパク質とヌクレオカプシドタンパク質が見つかりました。成人の4人に3人近くが時々痔核を患います。
COVID-19に感染した後に死亡した11人に対する別の剖検評価では、SARS-CoV-2の検査で陽性となった2人の個人が腸管にスパイクタンパク質を発見したことがわかりました。
副腎
副腎は、細菌やウイルスの感染を標的にされることがよくあります。
COVID患者の剖検に関する2つの研究では、患者の副腎皮質領域に局在するスパイクタンパク質が見つかりました。スパイクタンパク質の存在はまた、副腎の炎症、組織死、血液凝固、および他の多くの機能不全を伴っていました。副腎皮質細胞はホルモンの分泌に関与しているため、これらの領域への損傷は、将来的に副腎不全のリスクを高めると推測されています。
さらに、COVID-19ワクチンに関する論文では、ワクチンが副腎にスパイクタンパク質の生成に有利であり、副腎組織にスパイクタンパク質RNAとスパイクタンパク質が見られることもわかりました。
脾臓
Burkhardtのチームは、死亡したワクチン接種を受けた個人の脾臓の生検でスパイクタンパク質を発見しました。これらのスパイクタンパク質は脾臓の血管に存在していた。
COVID-19患者の剖検によって得られた脾臓組織を評価する別の研究では、脾臓細胞と脾臓に存在する免疫細胞にスパイクタンパク質が見つかりました。その結果、感染者の脾臓試料の損傷と組織死の兆候が大きく、スパイクタンパク質による脾臓損傷が示唆された。
目
スパイクタンパク質は、COVID-19で亡くなった3人の剖検中に、網膜の内層、網膜細胞の内部、および網膜に供給する血管で発見されました。COVID感染は、網膜の血管の拡大の増加と関連していることがわかっています, 視力障害の可能性につながる.
皮膚とエクリン細胞
少なくとも2つのケーススタディで、COVID-19感染後の皮膚および汗腺組織でSARS-CoV-2ウイルスが検出されました。これらの人々はしばしば感染部位に皮膚の変色があります。皮膚組織の臨床検査は、感染した組織の炎症および発赤を示した。
筋肉
Burkhadtのチームは、剖検研究から、死亡したワクチン接種を受けた個人の三角筋にスパイクタンパク質を発見しました。その部位には免疫細胞もあり、感染の可能性を示唆しています。彼らはまた、下腿の筋細胞にスパイクタンパク質を発見しました。
卵巣
COVID-19ワクチン接種後に生殖異常が報告されることはめったにありませんが、月経の変化は、ワクチン接種を受けた女性、またはワクチン接種を受けた個人と接触した女性でも容易に記録されています。
それにもかかわらず、イタリアのin vitro研究では、培養ヒト顆粒膜および積雲細胞を24時間、48時間、および72時間間隔でSARS-CoV-2ウイルスに曝露しました。その結果、すべての培養物でウイルス感染が見つかった。ウイルスは卵巣細胞に感染しました。しかし、COVID感染症に関する研究によると、女性は一般的に男性に比べてCOVID-19感染の影響を受けにくいことが示されています。
精巣
精巣は特にSARS-CoV-2の標的になっているようです。プレプリント研究では、精子の生産場所である精巣がウイルス複製の貯蔵庫であることがわかりました。これは、個人の精子産生のリスクをもたらす可能性があります。
中国の研究では、COVID-19に感染した後に死亡した5人の精巣にスパイクタンパク質が見つかりました。影響を受けた組織は精子形成に関与しており、炎症、損傷、および変性の兆候がありました。これらの知見は、精巣の損傷と精子形成の潜在的な障害をスパイクタンパク質の存在と相関させている。
研究により、感染後の精子からSARS-CoV-2ウイルスとそのウイルスRNAが検出されました。これらはしばしば精子数と運動性の低下と関連しており、感染が精子形成を損なうことを示唆しています。ワクチン接種を受けた個人に関する研究にも同様の発見があり、そのすべてがスパイクタンパク質自体が精子の生産を損なう可能性があることを示唆しています。