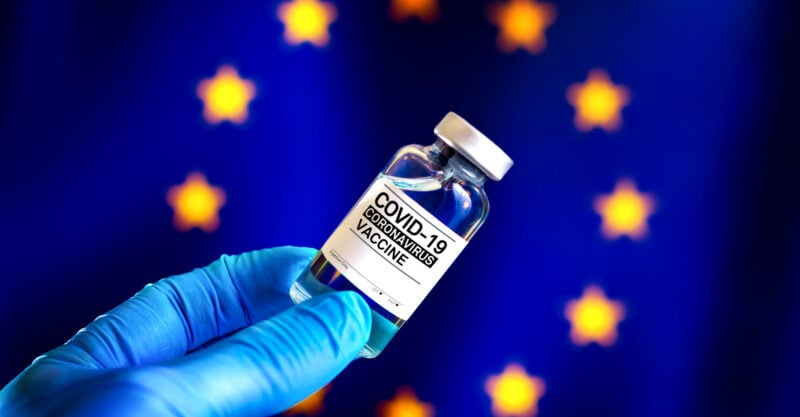
政府高官はEU規制当局にファイザーワクチンの承認を急ぐよう圧力をかけ、漏洩した文書が明らかに
欧州医薬品庁(European Medicines Agency)からリークされた文書によると、米国とEUの政府当局者は、安全性の懸念にもかかわらず、ファイザー・バイオNTechのCOVID-19ワクチンの承認を急ぐよう欧州の医薬品規制当局に圧力をかけた。
一日を逃し、たくさん逃す。The Defender’s Top News of the Dayを購読しましょう。それは無料です。
欧州医薬品庁(EMA)からリークされた文書によると、米国とEUの政府当局者は、安全性の懸念にもかかわらず、ファイザー・バイオNTechのCOVID-19ワクチンの承認を急ぐよう欧州の医薬品規制当局に圧力をかけた。
EMAは、米国食品医薬品局(FDA)のヨーロッパ版です。
Trial Site Newsが最初に報じた文書には、電子メール、PowerPointプレゼンテーション、および欧州、英国、米国の規制当局がワクチンを緊急使用のために承認するわずか数週間前の2020年11月10日から25日までの期間のファイザーの機密報告書が含まれています。
文書からの主な啓示には,次のものが含まれます。
- ワクチンを迅速に承認するラッシュは、米国とヨーロッパの政府関係者によって「強く押された」。
- ワクチンの安全性に関する専門家の懸念にもかかわらず、ファイザーワクチンを承認するよう欧州の規制当局に圧力をかけています。
- ファイザー-BioNTech COVID-19ワクチンのワクチン試験バッチと商業バッチの間でmRNAの有効性に大きな違いがあり、安全性の懸念が高まっています。
- これらの不一致に関しFDAからの「大きな関心」はありません。
- ファイザー-BioNTechワクチンが英国、米国、EUで規制当局の承認を受ける直前に、mRNA完全性の許容閾値の低下。
- ファイザーのアルバート・ブールラ最高経営責任者(CEO)が欧州委員会委員長とFDAのハイレベル規制当局に直接ロビー活動を行った。
政治家たちはファイザーのワクチン承認を「急ぐ」ために「強くプッシュ」した
2020年11月16日、当時EMAの生物学的健康の脅威とワクチン戦略の責任者であるマルコ・カヴァレリからの電子メールは、「[アレックス]アザールと米国政府[原文のまま]」が「EUA(緊急使用許可)に突入する」ために「強くプッシュ」したと述べています。
当時、アザールはFDAを監督する米国保健福祉省の秘書でした。
2020年11月19日、当時EMAの副事務局長であったノエル・ワティオン(Noel Wathion)は、電子メールの中で、ウルスラ・フォン・デア・ライエン欧州委員会委員に言及して、「TC」(電話会議の略語)を「コミッショナーと」と呼んだ。
ワティオンが「かなり緊張し、時には少し不愉快でさえある」と表現した電話会議の間、フォン・デア・ライエンはEMAに「期待が満たされていない場合」に、ファイザー・バイオNTechワクチンのCMA(条件付き販売承認)を迅速に発行するために何が起こるかを警告した。
同じ電子メールで、ワティオンはこう書いている。
「技術的なレベル 」で…科学的なレビューの結果をできるだけ強固なものにするために、このような遅延を擁護できたとしても、政治的な影響はあまりにも大きいようだ。
「私たちは、私たちが何をするにしても(FDAとMHRA(医薬品・ヘルスケア製品規制庁))による「承認」のタイミングにできるだけ合わせるためにプロセスを早めることと、特にCMC(化学、製造、管理ガイドライン)や安全性に関して強固な保証を得るために必要な時間をかけること)、EMAは、数週間遅れた場合、様々な関係者からの質問と批判という非常に大きな挑戦を抱えることになることを知っています。
ワティオンが言及した「様々な政党」には、欧州委員会、欧州議会、メディア、一般市民が含まれていた。
ワティオン氏はさらに、「CMC、責任、説明責任は、私の見解では確かに考慮すべき要素である」と主張した。
2020年11月22日付の後の電子メールで、ワティオンはファイザー-BioNTechワクチンのCMAを発行するために当局が直面していた圧力をさらに明らかにし、次のように書いている。
「CMAが認可される前にFDA(およびMHRA)がEUAを発行する可能性は非常に高いです。だから我々はこのために準備しなければならない」
しかし、ワティオンは同じ電子メールで、そのような準備がファイザーワクチンの適切な科学的評価を犠牲にして行われる可能性があると懸念を表明した。
「私たちは可能な限りスピードアップしていますが、科学的評価が可能な限り堅牢であることを確認する必要もあります」とワティオンは書いています。
ワティオンはまた、一方ではEUAやCMAと完全な承認との間の「一般大衆とメディアはニュアンスを理解できないだろう」と述べた。「彼らにとって、『承認』は承認です。
実際、メディアはファイザー、モデルナ、ジョンソン・エンド・ジョンソンのCOVID-19ワクチンを「承認済み」と呼ぶことがよくありますが、実際には米国ではEUAの下で投与されています。
ワティオン氏は、EMAが独自のCMAを発行する前に米国と英国の規制当局がEUAを発行する可能性に言及して、「損害制限から積極的な期待管理への移行に対処する」必要があると示唆した。
ワクチンバッチの完全性、一貫性に関する懸念は、基準の引き下げにつながったのでしょうか?
他の漏洩文書は、ファイザーのワクチンバッチの一貫性の不一致やその他の安全性の懸念を明らかにしています。
2020年11月10日、カヴァレリからの電子メールは、FDAが当時、「CMCに関するいくつかの問題を整理すべき」ことを認識しており、「CMCが最終的に困難なビットになる」という懸念を明らかにした。
同じ電子メールで、彼はFDAが2020年のクリスマスまでにEUAを付与する可能性があると述べ、EMAが「同時に」独自のCMAを付与できるかどうかを尋ねた。
カヴァレリが言及した「問題」は、ファイザー-BioNTechワクチンの臨床バッチと提案された市販バッチとの間のmRNA完全性における有意な不一致に関連していた。
2020年11月23日、EMAの科学管理者であるEvdokia Korakianitiに電子メールを送り、これらの問題に対処し、次のように書いています。
「問題:中間解析が実施された臨床バッチ(約78%mRNA完全性)と提案された市販バッチ(約55%)との間に、%RNA完全性/切断種に有意差が観察された。
「同社は、医薬品の有効性は送達されたRNAの発現に依存しており、これには十分に無傷のRNA分子が必要であると主張している。
これは、コラキアニティが後に同じメッセージで説明したように、製品の安全性にまだ特定されていない意味合いを持っていました。
「[原文のまま]市販のバッチにおける%RNA完全性の低下の根本原因はまだ特定されていません。
「市販のバッチにおけるこのRNA完全性の喪失が、安全性と有効性の両面で臨床的なバッチと比較して潜在的に意味する影響はまだ定義されていません。
漏洩した文書の一部であるファイザーの43ページの機密報告書は、この不一致の重要性についてのさらなる洞察を提供しました。
報告書によると、ファイザー-BioNTechおよびモデルナCOVID-19ワクチンで使用される脂質ナノ粒子プラットフォームを開発したAcuitas Therapeuticsは、mRNA完全性の「最小閾値」を「約70%」に設定しました。
レポートには次のように記載されています。
「製品の有効性は、送達されたRNAの発現に依存しており、これには十分に無傷なRNA分子が必要です。
2020年11月24日、コラキアニティの電子メールへの返信で、EMAの薬局品質オフィスの責任者であるVeronika Jekerleは、これらの懸念を「ワクチンの利益/リスク(有効性/安全性)に影響を与える多くの主要な懸念」の一部として説明しました。
ジェカレは、EUの「これらの懸念はほとんどの加盟国によって共有されている」と述べた。
しかし、ジェカレは、「これらの懸念+GMP(適正製造慣行)が解決されれば、年末までに承認が可能になる可能性がある」と示唆した。
明らかな矛盾の中で、そしておそらくEMA側のスタンスの変化を明らかにして、2020年11月23日、カヴァレリによる電子メールは次のように述べています。mRNA含有量の問題は、大きな問題として認識されていません。
同じ電子メールはまた、カヴァレリが「FDAから大きな関心はない」と書いたように、FDAが同様に感じていることを強く示唆していた。
2020年11月25日、ジェカレからの電子メールは、mRNAの完全性の問題に関するFDAを含むいくつかの規制当局の関心の欠如をさらに確認しました。
ジェカレは 書きました:
「FDAとカナダ保健省[HC]は、可変種のmRNA/タンパク質に関連する安全性の懸念は、より理論的な懸念事項であることを示しました…
「FDA/HC/EMAは、1つの領域[原文のまま]がすべての最適でない材料を得ることを避けるために、仕様%B mRNAの完全性に関するアライメントが重要であることに同意しました…仕様は臨床的に適格であるべきです。
上記のパッセージは、mRNA完全性におけるこの不一致の結果として、特定のワクチンバッチが「最適ではない」ことを示しているように思われる。
ジェカレの2020年11月25日の電子メールはまた、さらなる潜在的な安全性の懸念を明らかにしました – すなわち、「申請者は今日だけDP(医薬品)中の目に見える粒子(脂質ナノ粒子成分であるように見える)の問題をFDAおよび私たち/ MHRAと共有しました。
言い換えれば、「申請者」であるファイザーは、2020年11月25日、米国、英国、EUの規制当局がファイザーに緊急かつ条件付きの承認を与える直前の2020年11月25日に規制当局に懸念を明らかにしました。
例えば、MHRAは2020年12月2日にファイザーのワクチンを承認しました。
mRNA完全性の不一致に関する懸念は、検討中の生成物を変更することによってではなく、許容可能なRNA完全性仕様を変更することによって克服されたようである。
ジェカレの電子メールのわずか1日後に行われた2020年11月26日のEMAとファイザーの会談に言及した、リークされたPowerPointプレゼンテーションには、次のように書かれています。
「…私たち(EMA)は、原薬のRNA完全性仕様を>=60%、医薬品の放出を>=55%、医薬品の貯蔵寿命を>=50%に改訂しています。

これらの変更は、同じスライドで「製品の安全性と市販製品の有効性に関する不確実性」という言及にもかかわらず行われました。
同じプレゼンテーションの別のスライドには、次のように記載されています。
「切断された、修飾されたRNA種は、製品関連の不純物と見なされるべきです。
「さらに、切断されたおよび/または改変されたmRNA種から生じる、意図されたスパイクタンパク質(S1S2)以外の翻訳タンパク質の可能性に対処し、優勢な種の関連するタンパク質特性評価データが利用可能であれば提供されるべきである。

製薬会社の幹部が規制当局にロビー活動を行い、迅速な承認を求める
リークされた文書は、ファイザー-BioNTechワクチンのより堅牢な科学的評価が必要であるというEMA専門家の感情にもかかわらず、ワクチンの迅速な承認を支持する高レベルの製薬会社や政治家からの激しいロビー活動を明らかにした。
例えば、カヴァレリからの別の電子メールは、FDAの生物製剤評価研究センターの所長であるピーター・マークス博士に対するファイザーの直接のロビー活動に明示的に言及しています。
カヴァレリ 書きました:
「ファイザーのCEOはピーター・マークスにロビー活動を行い、EMAはもっと早くデータが欲しいと伝えた!!」
同じ電子メールは、EMAの「同僚」がファイザーのワクチンの「レビュー時間枠を圧縮するために懸命にプッシュしている」と述べています。
Trial Site Newsによると、そのようなロビー活動は「非常に物議を醸すものと解釈される可能性がある」という。
「ファイザーが連邦政府の監視機関に明らかにアクセスしていることは、少なくとも重大な疑問を提起する」とTrial Site Newsは報じ、「業界と、独立しているとされる科学的な連邦機関との間の不穏な絡み合いの可能性を紹介している」と報じた。
Trial Site Newsはまた、2022年2月、フォン・デア・ライエンがブルラとプライベートなテキストメッセージを交換したことを明らかにした後、フォン・デア・ライエンの辞任を求める欧州議会の独立議員の呼びかけにも言及した。
「これらのテキストのほんの一部しか開示されなかった」とTrial Site Newsは述べたが、リリースされたものは「一連のテキストを通じて、ブルラと一方的にヨーロッパ全体のワクチン取引の交渉部分を明らかにした」と述べた。